4NH3(g)+5O2(g)  4NO (g)+6H2O(g)是工业制备硝酸的重要反应,此反应在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此时间内,若用NO的浓度变化来表示此反应的速率,则v(NO)应为
4NO (g)+6H2O(g)是工业制备硝酸的重要反应,此反应在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此时间内,若用NO的浓度变化来表示此反应的速率,则v(NO)应为
A.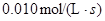 |
B.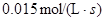 |
C.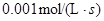 |
D.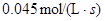 |
4NH3(g)+5O2(g)  4NO (g)+6H2O(g)是工业制备硝酸的重要反应,此反应在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此时间内,若用NO的浓度变化来表示此反应的速率,则v(NO)应为
4NO (g)+6H2O(g)是工业制备硝酸的重要反应,此反应在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此时间内,若用NO的浓度变化来表示此反应的速率,则v(NO)应为
A.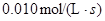 |
B.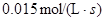 |
C.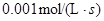 |
D.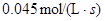 |