(4分) 已知:
①P4(S,白磷)+5O2(g)= P4O10(S)△H = —2983.2kJ•mol-1
②P(S,红磷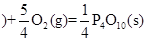 △H = —738.5kJ•mol-1
△H = —738.5kJ•mol-1
(1)写出白磷转化为红磷的热化学方程式: 。
(2)则对应下列化学反应过程中的能量变化图,能正确反映出由白磷转化为红磷的是[选填A ~ D] 。
(4分) 已知:
①P4(S,白磷)+5O2(g)= P4O10(S)△H = —2983.2kJ•mol-1
②P(S,红磷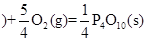 △H = —738.5kJ•mol-1
△H = —738.5kJ•mol-1
(1)写出白磷转化为红磷的热化学方程式: 。
(2)则对应下列化学反应过程中的能量变化图,能正确反映出由白磷转化为红磷的是[选填A ~ D] 。