用稀盐酸和氢氧化钡溶液进行酸碱中和反应实验,该反应过程中溶液酸碱度变化及相关数据如右图所示。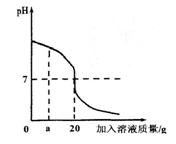
(1)根据此变化曲线,你认为实验操作是将 滴加到另一种溶液中。
(2)当加入溶液质量是a g时,溶液中溶质是 (写化学式)。
(3)若用pH试纸测定溶液的酸碱度,请写出测定方法: 。
(4)当pH=7时,测得生成氯化钡的物质的量为0.05mol,求盐酸中溶质的质量分数?
用稀盐酸和氢氧化钡溶液进行酸碱中和反应实验,该反应过程中溶液酸碱度变化及相关数据如右图所示。
(1)根据此变化曲线,你认为实验操作是将 滴加到另一种溶液中。
(2)当加入溶液质量是a g时,溶液中溶质是 (写化学式)。
(3)若用pH试纸测定溶液的酸碱度,请写出测定方法: 。
(4)当pH=7时,测得生成氯化钡的物质的量为0.05mol,求盐酸中溶质的质量分数?