某密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是( )
2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是( ) 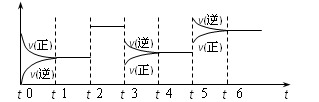
| A.t5时增大了压强 | B.t3时降低了温度 |
| C.t2时加入了催化剂 | D.t4~t5时间内转化率一定最低 |
某密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是( )
2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是( ) 
| A.t5时增大了压强 | B.t3时降低了温度 |
| C.t2时加入了催化剂 | D.t4~t5时间内转化率一定最低 |