工业制纯碱时,第一步通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠结晶。它的反应原理可以用下面的方程式表示:
NH3+CO2+H2O==NH4HCO3,NH4HCO3+NaCl(饱和)==NaHCO3↓+NH4Cl
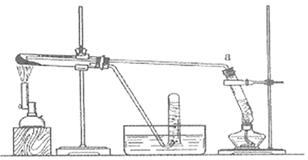
以上反应的总结果是放热反应。下面设计了一个实验,用最简单的实验装置模拟实验这一过程,获得碳酸钠结晶。可供选择的实验用品有:稀盐酸、稀硫酸、浓氨水、氢氧化钠、消石灰、石灰石、氯化铵、食盐、蒸馏水和冰,以及中学化学实验常用仪器。实验装置示意图(包括反应时容器中的物质)如下,图中玻璃容器旁自左至右分别用A、B、C……符号标明(请见题后说明)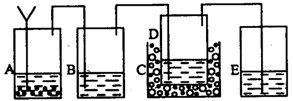
(1)请写出在图上A、B、C……各玻璃容器中盛放物质的化学式或名称。
A:__________________,B:___________________,C:__________________,
D:__________________,E_____________________。
(2)利用在本题所提供的实验用品,如何判断得到的产品是碳酸氢钠的结晶,而不是碳酸氢铵或食盐结晶?


 粤公网安备 44130202000953号
粤公网安备 44130202000953号