(14分) (1) 2009年,长春应用化学研究所在甲醇燃料电池技术上获得新突破,原理如下图所示。
①请写出从C口通入O2发生的电极反应式___________________。
②以石墨电极电解饱和食盐水,电解开始后在______________的周围(填“阴极”或“阳极”)先出现红色。假设电池的理论效率为80%(电池的理论效率是指电池产生的最大电能与电池反应所释放的全部能量之比),若消耗6.4g甲醇气体,外电路通过的电子个数为__________________(保留两位有效数字)。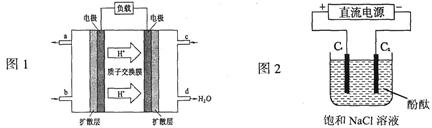
(2)工业废水中常含有Cu2+等重金属离子,直接排放会造成污染,目前在工业废水处理过程中,依据沉淀转化的原理,常用FeS等难溶物质作为沉淀剂除去这些离子。已知室温下Ksp(FeS)=6.3×10-18mol2•L-2,Ksp(CuS)=1.3×10-36mol2•L-2。
请用离子方程式说明上述除杂的原理___________________________________________。
(3)工业上为了处理含有Cr2O72-的酸性工业废水,用绿矾(FeSO4·7H2O)把废水中的六价铬离子还原成三价铬离子,再加入过量的石灰水,使铬离子转变为Cr(OH)3沉淀。
①氧化还原过程的离子方程式为______________________________________________。
②常温下,Cr(OH)3的溶度积Ksp =1×10—32 mol4•L-4,溶液的pH至少为____,才能使Cr3+沉淀完全。
③现用上述方法处理100m3含铬(+6价)78mg•L—1的废水,需用绿矾的质量为 kg。(保留主要计算过程)
 )。
)。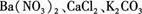 ,现做以下实验。
,现做以下实验。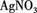 溶液,有白色沉淀生成。
溶液,有白色沉淀生成。 现象,判断白色粉末中一定含有(填化学式),可能含自(填化学式)。写出(3)中有关反应的离子方程式。
现象,判断白色粉末中一定含有(填化学式),可能含自(填化学式)。写出(3)中有关反应的离子方程式。 写出小苏打的化学
写出小苏打的化学 .白酒 B.食醋 C.酱油 D.白糖
.白酒 B.食醋 C.酱油 D.白糖

 粤公网安备 44130202000953号
粤公网安备 44130202000953号