今有X(g)+Y(g) 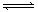 2Z(g) △H<0。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,据右图回答:从t2→t3的曲线变化是由哪种条件引起的( )
2Z(g) △H<0。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,据右图回答:从t2→t3的曲线变化是由哪种条件引起的( )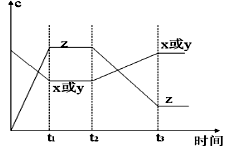
| A.增大X或Y的浓度 | B.增大压强 | C.增大Z的浓度 | D.升高温度 |
今有X(g)+Y(g) 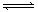 2Z(g) △H<0。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,据右图回答:从t2→t3的曲线变化是由哪种条件引起的( )
2Z(g) △H<0。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,据右图回答:从t2→t3的曲线变化是由哪种条件引起的( )
| A.增大X或Y的浓度 | B.增大压强 | C.增大Z的浓度 | D.升高温度 |