. 金晶体是面心立方体,立方体的每个面上5个金原子紧密堆砌(如图3,其余各面省略),金原子半径为A cm,求: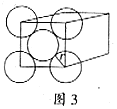
(1)金晶体中最小的一个立方体含有___________个金原子。
(2)金的密度为___________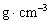 。(用带A计算式表示)
。(用带A计算式表示)
(3)金原子空间占有率为___________。(Au的相对原子质量为197,
用带A计算式表示)
. 金晶体是面心立方体,立方体的每个面上5个金原子紧密堆砌(如图3,其余各面省略),金原子半径为A cm,求:
(1)金晶体中最小的一个立方体含有___________个金原子。
(2)金的密度为___________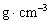 。(用带A计算式表示)
。(用带A计算式表示)
(3)金原子空间占有率为___________。(Au的相对原子质量为197,
用带A计算式表示)