(1)如图所示装置,回答下列问题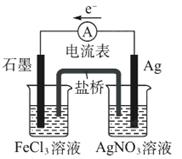
盐桥中阴离子移向 溶液,正极电极反应式为 ,该装置中发生的总反应的离子方程式为 。
(2)氨气若在纯氧中燃烧,则发生反应为4NH3+3O2点燃 2N2+6H2O,科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极是______(填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为 。
(1)如图所示装置,回答下列问题
盐桥中阴离子移向 溶液,正极电极反应式为 ,该装置中发生的总反应的离子方程式为 。
(2)氨气若在纯氧中燃烧,则发生反应为4NH3+3O2点燃 2N2+6H2O,科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极是______(填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为 。