分子式为C2H6O的化合物A具有如下性质: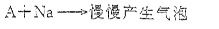
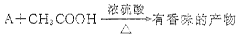
(1)根据上述信息,对该化合物可作出的判断是 。
| A.一定含有—OH | B.一定含有—COOH | C.A为乙醇 | D.A为乙酸 |
(2)含A的体积分数为75%的水溶液可以用作 。
(3)A与钠反应的化学方程式: 。
(4)写出A与CH3COOH反应产生有香味产物的化学方程式: 。
分子式为C2H6O的化合物A具有如下性质: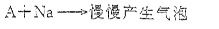
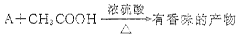
(1)根据上述信息,对该化合物可作出的判断是 。
| A.一定含有—OH | B.一定含有—COOH | C.A为乙醇 | D.A为乙酸 |
(2)含A的体积分数为75%的水溶液可以用作 。
(3)A与钠反应的化学方程式: 。
(4)写出A与CH3COOH反应产生有香味产物的化学方程式: 。