发射卫星用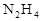 作燃料,
作燃料,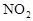 作氧化剂,两者反应生成N2和水蒸气,已知:
作氧化剂,两者反应生成N2和水蒸气,已知: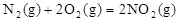 △H1=+67.7kJ/mol
△H1=+67.7kJ/mol
N2H4(g)+O2(g)= N2(g)+2H2O(g) △H2=-534kJ/mol
试写出N2H4与 NO2反应的热化学方程式
。
发射卫星用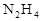 作燃料,
作燃料,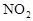 作氧化剂,两者反应生成N2和水蒸气,已知:
作氧化剂,两者反应生成N2和水蒸气,已知: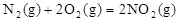 △H1=+67.7kJ/mol
△H1=+67.7kJ/mol
N2H4(g)+O2(g)= N2(g)+2H2O(g) △H2=-534kJ/mol
试写出N2H4与 NO2反应的热化学方程式
。