500℃时,将SO2和O2置于一容积固定为2 L的密闭容器中发生反应。反应过
程中SO2、O2和SO3物质的量变化如图所示,请回答下列问题:(1)反应10 min至15 min,
O2的平均反应速率为 mol·(L·min)-1,比反应开始时前10 min速率 ,可能的原
因是 。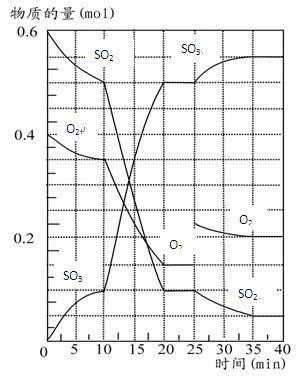
(2)从曲线变化可以看出,反应进行至25min时,采取了 使得平衡向
方向移动,达到新平衡后SO2的体积分数比原平衡小。
500℃时,将SO2和O2置于一容积固定为2 L的密闭容器中发生反应。反应过
程中SO2、O2和SO3物质的量变化如图所示,请回答下列问题:(1)反应10 min至15 min,
O2的平均反应速率为 mol·(L·min)-1,比反应开始时前10 min速率 ,可能的原
因是 。
(2)从曲线变化可以看出,反应进行至25min时,采取了 使得平衡向
方向移动,达到新平衡后SO2的体积分数比原平衡小。