某探究小组废弃的印刷线路板(含Cu、A1少量Au、Pt等金属的混合物)回收Cu并制备硫酸铝晶体[A12(SO4)3.18H2O],设计路线如下:
(1)过滤时所需要的玻璃仪器有玻璃棒、 、 。
(2)实验时需对滤渣2进行洗涤,判断洗涤是否干净的实验操作方法是 。
(3)为确定加入铁粉的量,实验中需测定滤液1中Cu2+的量。实验操作为:除去H2O2;准确量取一定体积滤液1于带塞锥形瓶中,加水稀释,调节溶液pH=3-4,加入过量KI-淀粉溶液,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式: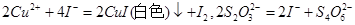
①滴定管在注入Na2S2O3标准溶液之前,要先用蒸馏水洗净,再用 。
②滴定终点观察到的现象为 。
③若滴定前溶液中的H2O2没有除尽,所测定的 含量将会 (填“偏高”、“偏
含量将会 (填“偏高”、“偏
低”或“不变”)
(4)由滤液2制取硫酸铝晶体,探究小组设计了如下二种方案:
甲: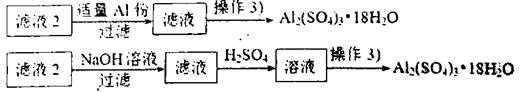
乙:
①操作③的实验步骤依次为:蒸发浓缩: 、 、洗涤。
②从原子利用率角度考虑, 方案更合理。(填“甲”或“乙”)
(5)他们查阅了资料,认为通过先氧化、再调节溶液pH也可将滤液2中的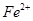 除去。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mo1.L-1计算)。
除去。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mo1.L-1计算)。
| |
开始沉淀的pH |
沉淀完全的pH |
| Fe3+ |
1.1 |
3.2 |
| Fe2+ |
5.8 |
8.8 |
| A13+ |
3.8 |
5.2 |
①氧化需加入H2O2而不用C12的原因是 。
②调节溶液pH约为 。
 再加热一定时间,放入干燥器中冷却至室温后称量。重复本操作,直至两次称量结果不变;
再加热一定时间,放入干燥器中冷却至室温后称量。重复本操作,直至两次称量结果不变; 再加热一定时间,放入干燥器中冷却至室温后称量。重复本操作,直至两次称量结果不变;
再加热一定时间,放入干燥器中冷却至室温后称量。重复本操作,直至两次称量结果不变;
 (s)+4CO(g)△H="+569.99" kJ/mol,欲使该反应发生并维持该反应进行的条件是 。
(s)+4CO(g)△H="+569.99" kJ/mol,欲使该反应发生并维持该反应进行的条件是 。  a 2S 2O 3+□CO 2
a 2S 2O 3+□CO 2  +、SO
+、SO  都大量减少,该物质是 。
都大量减少,该物质是 。
 铬(Cr 2O 3难溶于水)需用蒸馏水洗涤的原因 ,如何用简单方法判断其已洗涤干净 。
铬(Cr 2O 3难溶于水)需用蒸馏水洗涤的原因 ,如何用简单方法判断其已洗涤干净 。 
 瓶中通人氮气,使CCl 4蒸气经氮气载人反应室进行反应,继续升温到650℃;③三颈烧瓶中装入150mLCCl 4,并加热CCl 4,温度控制在5
瓶中通人氮气,使CCl 4蒸气经氮气载人反应室进行反应,继续升温到650℃;③三颈烧瓶中装入150mLCCl 4,并加热CCl 4,温度控制在5  0~60℃之间;④反应管出口端出现了CrCl 3升华物时,切
0~60℃之间;④反应管出口端出现了CrCl 3升华物时,切  需在通风橱中进行,并用乙醇处理COCl 2,生成一种含氧酸酯(C 5H 10O 3),用乙醇处理尾气的化学方程式为 。
需在通风橱中进行,并用乙醇处理COCl 2,生成一种含氧酸酯(C 5H 10O 3),用乙醇处理尾气的化学方程式为 。  锥形瓶)中,加热至沸后加入1gNa 2O 2,充分加热煮沸,适当稀释,
锥形瓶)中,加热至沸后加入1gNa 2O 2,充分加热煮沸,适当稀释,  然后加入过量的2mol/LH 2SO 4至溶液呈强酸性,此时铬以Cr 2O
然后加入过量的2mol/LH 2SO 4至溶液呈强酸性,此时铬以Cr 2O  存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,
存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,  2后也要加热煮沸,其主要原因是 。
2后也要加热煮沸,其主要原因是 。  水三氯化铬的质量分数为 。
水三氯化铬的质量分数为 。 粤公网安备 44130202000953号
粤公网安备 44130202000953号