(共10分)有下列各组物质:
| A.O2和O3(臭氧) |
B. 和 和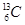 |
C.CH3CH2CH2CH3和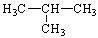 |
D.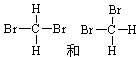 |
E.甲烷和庚烷
F.(CH3)2CH2与C(CH3)4
G.金刚石和石墨
H.液氯与氯气
(1) 组两物质互为同位素 (2) 组两物质互为同素异形体
(3) 组两物质属于同系物 (4) 组两组物质互为同分异构体
(5) 组中的物质是同一物质
(共10分)有下列各组物质:
| A.O2和O3(臭氧) |
B. 和 和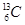 |
C.CH3CH2CH2CH3和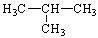 |
D.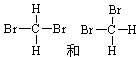 |
E.甲烷和庚烷
F.(CH3)2CH2与C(CH3)4
G.金刚石和石墨
H.液氯与氯气
(1) 组两物质互为同位素 (2) 组两物质互为同素异形体
(3) 组两物质属于同系物 (4) 组两组物质互为同分异构体
(5) 组中的物质是同一物质