(18分)根据下图回答问题:
(1)A图是某离子化合物的晶胞(组成晶体的一个最小重复单位),阳离子位于中间,阴离
子位于8个顶点,该化合物中阳、阴离子的个数比是_______________。
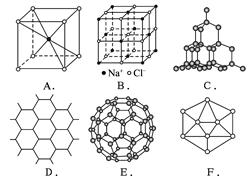
(2)B图表示构成NaCl晶体的一个晶胞,通过想像与推理,可确定一个NaCl晶胞中含Na+
和Cl-的个数分别为_______________、_______________。
(3)C图是金刚石的晶体结构,C60、金刚石和石墨三者的关系是_______________。
| A.同分异构体 |
B.同素异形体 |
C.同系物 |
D.同位素 |
硅晶体的结构跟金刚石相似,1 mol硅晶体中含有硅硅单键的数目约是_______________NA个。二氧化硅的结构相当于在硅晶体结构中每个硅—硅单键之间插入一个氧原子。二氧化硅的空间网状结构中,硅、氧原子形成的最小环上原子数目是_______________。
(4)石墨晶体结构如D图所示,每一层由无数个正六边形构成,则平均每一个正六边形所占有的碳原子数为_______________,“C—C”键数为_______________。
(5)足球烯C60结构形如足球,如E图,则C60中有_______________个六边形,_______________个五边形。固态时,C60属于_______________ (填“离子”、“原子”或“分子”)晶体,C60分子中含有双键的数目是_______________。
(6)晶体硼的基本结构单元都是由硼原子组成的正二十面体的原子晶体,如F图。其中含有
20个等边三角形和一定数目的顶角,每个顶角上各有1个原子。试观察F图,推断这个基本结构单元所含硼原子个数、键角、“B—B”键的个数依次为______________、_______________、_______________。
 Li的质量是 g。
Li的质量是 g。 Li的质量是 g。
Li的质量是 g。