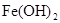 由于在空气中易被氧化,制取时很难观察到白色沉淀现象,只能看到灰绿色,采用图装置使用
由于在空气中易被氧化,制取时很难观察到白色沉淀现象,只能看到灰绿色,采用图装置使用 ,
, (稀),NaOH溶液可在还原性气氛中制取
(稀),NaOH溶液可在还原性气氛中制取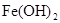 白色沉淀,且较长时间内不变色,其中C为弹簧夹,则锥形瓶A中应加入的药品为________,锥形瓶B中应加入的药品为________.容器A中的反应开始后,请设计后续操作步骤完成的制备,并说明每步操作理由和现象.
白色沉淀,且较长时间内不变色,其中C为弹簧夹,则锥形瓶A中应加入的药品为________,锥形瓶B中应加入的药品为________.容器A中的反应开始后,请设计后续操作步骤完成的制备,并说明每步操作理由和现象.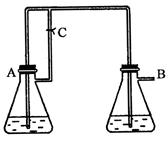
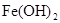 由于在空气中易被氧化,制取时很难观察到白色沉淀现象,只能看到灰绿色,采用图装置使用
由于在空气中易被氧化,制取时很难观察到白色沉淀现象,只能看到灰绿色,采用图装置使用 ,
, (稀),NaOH溶液可在还原性气氛中制取
(稀),NaOH溶液可在还原性气氛中制取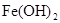 白色沉淀,且较长时间内不变色,其中C为弹簧夹,则锥形瓶A中应加入的药品为________,锥形瓶B中应加入的药品为________.容器A中的反应开始后,请设计后续操作步骤完成的制备,并说明每步操作理由和现象.
白色沉淀,且较长时间内不变色,其中C为弹簧夹,则锥形瓶A中应加入的药品为________,锥形瓶B中应加入的药品为________.容器A中的反应开始后,请设计后续操作步骤完成的制备,并说明每步操作理由和现象.