已知黑色固体X可溶于盐酸,白色固体Y既可溶于盐酸,又可溶于NaOH溶液,C为棕红色,E是金属,如下所示,它们之间有下列变化(其反应条件均略去):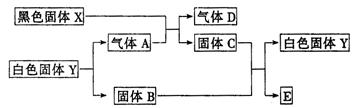
(1)写出化学式: X__________________________;D__________________________;
(2)写出Y溶于NaOH溶液的离子方程式:______________________________;
(3)写出B与C反应的化学方程式:______________________________.
已知黑色固体X可溶于盐酸,白色固体Y既可溶于盐酸,又可溶于NaOH溶液,C为棕红色,E是金属,如下所示,它们之间有下列变化(其反应条件均略去):
(1)写出化学式: X__________________________;D__________________________;
(2)写出Y溶于NaOH溶液的离子方程式:______________________________;
(3)写出B与C反应的化学方程式:______________________________.