掌握化学实验中常用仪器的特征和用途,有利于开展化学学习和研究。请从下列常见仪器图示中,选择恰当的字母序号填空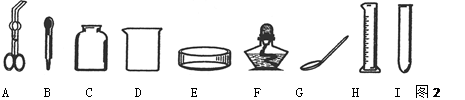
(1)可以直接在酒精灯火焰上加热的玻璃仪器是 ;
(2)镁条燃烧时,用来夹持镁条的仪器是 ;
(3)取用粉末状固体药品用到的仪器是 ;
(4)吸取和滴加少量液体试剂的仪器是 。
掌握化学实验中常用仪器的特征和用途,有利于开展化学学习和研究。请从下列常见仪器图示中,选择恰当的字母序号填空
(1)可以直接在酒精灯火焰上加热的玻璃仪器是 ;
(2)镁条燃烧时,用来夹持镁条的仪器是 ;
(3)取用粉末状固体药品用到的仪器是 ;
(4)吸取和滴加少量液体试剂的仪器是 。