(10分)根据下列变化关系: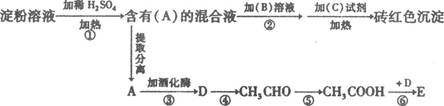
请填空:
(1)A物质的名称_____ 。B溶液为____________.作用为_________________________
(2)写出④、⑥两步反应的化学方程式,在( )号中标明反应类型。
④ ________________________________________( )
⑥_______________________________________________( )
(10分)根据下列变化关系:
请填空:
(1)A物质的名称_____ 。B溶液为____________.作用为_________________________
(2)写出④、⑥两步反应的化学方程式,在( )号中标明反应类型。
④ ________________________________________( )
⑥_______________________________________________( )