为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2粉末于 50 mL密度为1.1g∙cm-3的双氧水溶液中,通过实验测定:在标准状况下放出气体的体积和时间的关系如右图所示。请依图回答下列问题: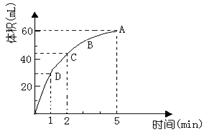
(1)实验时放出气体的总体积为 ___ ;
(2)放出一半气体所需要的时间为 ______ ;
(3)ABCD四点化学反应速率的由快到慢顺序为 ___________ ;
(4)在5min后,收集到的气体体积不再增加,原因是 。
为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2粉末于 50 mL密度为1.1g∙cm-3的双氧水溶液中,通过实验测定:在标准状况下放出气体的体积和时间的关系如右图所示。请依图回答下列问题:
(1)实验时放出气体的总体积为 ___ ;
(2)放出一半气体所需要的时间为 ______ ;
(3)ABCD四点化学反应速率的由快到慢顺序为 ___________ ;
(4)在5min后,收集到的气体体积不再增加,原因是 。