下图表示某淡黄色固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。B和C的相对分子质量相差16,化合物D是重要的工业原料。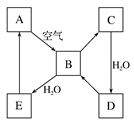
(1)单质A的名称 ________。
(2)写出E与A的氢化物反应生成A的化学方程式__________________________。
(3)写出一个由D生成B的化学方程式______________________。
下图表示某淡黄色固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。B和C的相对分子质量相差16,化合物D是重要的工业原料。
(1)单质A的名称 ________。
(2)写出E与A的氢化物反应生成A的化学方程式__________________________。
(3)写出一个由D生成B的化学方程式______________________。