2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的 ΔH=—99kJ·mol-1.请回答下列问题: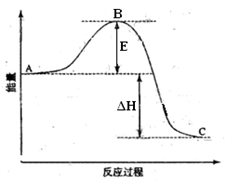
(1)图中A、C分别表示 、 ,
E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是
(2)图中△H= KJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式:
、
;
(4)如果反应速率υ(SO2)为0.05 mol·L-1·min-1
,则υ(O2)= mol·L-1·min-1、
υ(SO3)= mol·L-1·min-1;
(5)已知单质硫的燃烧热为296 KJ·mol-1,求由S(s)生成3 molSO3(g)的△H= 。

 2SO3,并达平衡后。B容器中SO2的质量分数(填“ >”、“ < ”或“=”) A 容器中SO2的质量分数
2SO3,并达平衡后。B容器中SO2的质量分数(填“ >”、“ < ”或“=”) A 容器中SO2的质量分数
 Sn(s,白) ΔH=+2.1 kJ/mol,△S=6.5J·mol-1.;求出灰锡器皿不损坏的温度是℃((填“ >”、“ < ”或“=”)
Sn(s,白) ΔH=+2.1 kJ/mol,△S=6.5J·mol-1.;求出灰锡器皿不损坏的温度是℃((填“ >”、“ < ”或“=”)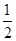 O2(g)=H2O(l)△H=-285.84kJ·mol-1
O2(g)=H2O(l)△H=-285.84kJ·mol-1 粤公网安备 44130202000953号
粤公网安备 44130202000953号