(4分)可逆反应2A(g) 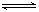 B(g)(放热反应)从反应开始至建立平衡后改变某一外界条件(外界条件指的是温度、压强、浓度和催化剂)使平衡发生了移动至新的平衡,该过程中各物质的浓度(用c表示)随时间变化情况如下图所示,试分析各图,指出导致平衡移动的因素和平衡移动的方向:
B(g)(放热反应)从反应开始至建立平衡后改变某一外界条件(外界条件指的是温度、压强、浓度和催化剂)使平衡发生了移动至新的平衡,该过程中各物质的浓度(用c表示)随时间变化情况如下图所示,试分析各图,指出导致平衡移动的因素和平衡移动的方向: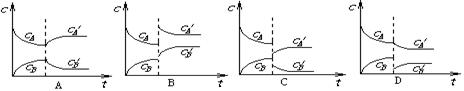
| 序号 |
平衡移动的因素 |
平衡移动的方向 |
| A |
|
|
| B |
|
|
| C |
|
|
| D |
|
|
(4分)可逆反应2A(g) 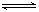 B(g)(放热反应)从反应开始至建立平衡后改变某一外界条件(外界条件指的是温度、压强、浓度和催化剂)使平衡发生了移动至新的平衡,该过程中各物质的浓度(用c表示)随时间变化情况如下图所示,试分析各图,指出导致平衡移动的因素和平衡移动的方向:
B(g)(放热反应)从反应开始至建立平衡后改变某一外界条件(外界条件指的是温度、压强、浓度和催化剂)使平衡发生了移动至新的平衡,该过程中各物质的浓度(用c表示)随时间变化情况如下图所示,试分析各图,指出导致平衡移动的因素和平衡移动的方向:
| 序号 |
平衡移动的因素 |
平衡移动的方向 |
| A |
|
|
| B |
|
|
| C |
|
|
| D |
|
|