(每空2分,共6分)在下图所示的实验装置中,A中盛有品红溶液,B 中盛有NaOH溶液。请回答下列问题: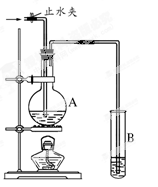
(1)若向A中通入足量的二氧化硫气体,A中的现象是 。
(2)如果A中盛的是浓硫酸,加入铜,加热反应,此反应中表现浓硫酸的酸性和 性。
(3)如果A中盛的是浓盐酸,加入二氧化锰,加热反应,此反应中浓盐酸的作用是 。
(每空2分,共6分)在下图所示的实验装置中,A中盛有品红溶液,B 中盛有NaOH溶液。请回答下列问题:
(1)若向A中通入足量的二氧化硫气体,A中的现象是 。
(2)如果A中盛的是浓硫酸,加入铜,加热反应,此反应中表现浓硫酸的酸性和 性。
(3)如果A中盛的是浓盐酸,加入二氧化锰,加热反应,此反应中浓盐酸的作用是 。