本题包含两部分.请分别作答:
(Ⅰ).NO分子曾因污染空气而臭名昭著,但随着其“扩张血管、免疫、增强记忆”功能的发现,现在成为当前生命科学研究中的“明星分子”,回答下列问题
(1)NO的危害在于
a.破坏臭氧层
b.参与酸雨和光化学烟雾的形成
c.与人体内血红蛋白结合
d.当它转化为N2后使空气中O2含量降低
(2)一定条件下NO可转化为N2O和另一种红棕色气体,方程式为 。
(3)镁铁混合物4.9g,溶解在过量的某浓度的稀硝酸中,完全反应后得到标准状况下2.24L NO 气体。若向反应后的溶液中加入足量的烧碱,则可生成沉淀的质量是______________。
(Ⅱ).1L某混合溶液,可能含有的离子如下表:
可能大量含有的阳离子
|
H+ NH4+ Al3+ K+
|
可能大量含有的阴离子
|
Cl- Br- I- ClO- AlO2-
|
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积(v)的关系如下图所示。
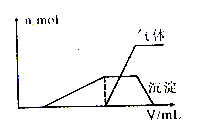
则该溶液中确定含有的离子有 ;肯定不含有的离子有 ,
(2)若经检测,该溶液中含有大量的Cl—、Br—、I—,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl—、Br—、I—的物质的量与通入Cl2的体积(标准状况下)的关系如下图所示,回答下列问题:
Cl2的体积(标准状况)
|
2.8L
|
5.6L
|
11.2L
|
n (Cl-)
|
1.25mol
|
1.5mol
|
2mol
|
n (Br-)
|
1.5mol
|
1.4mol
|
0.9mol
|
n(I-)
|
a mol
|
0
|
0
|
①当通入的Cl2的体积为2.8L时,溶液中发生反应的离子方程式为: ,a= 。
②原溶液中Cl—、Br—、I—的物质的量浓度之比为 。