实验室里用下图所示装置制取纯净的无水CuCl2。试回答下列问题: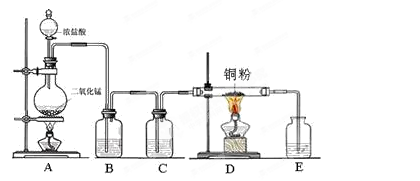
(1)写出烧瓶中发生反应的化学方程式,并标出电子转移情况 。
(2)C处盛放的试剂 (填名称),其作用是 。
(3)E处盛有 (填名称),发生反应的离子方程式为 。
(4)实验结束时,应先熄灭 处酒精灯。
实验室里用下图所示装置制取纯净的无水CuCl2。试回答下列问题:
(1)写出烧瓶中发生反应的化学方程式,并标出电子转移情况 。
(2)C处盛放的试剂 (填名称),其作用是 。
(3)E处盛有 (填名称),发生反应的离子方程式为 。
(4)实验结束时,应先熄灭 处酒精灯。