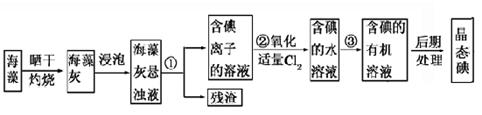
(10分)成都七中文艺青年小组进行了关于“活泼金属与酸反应”的实验,得出了一些有趣的想法,请你帮助他们,完成一些判断。将5.4g铝片投入500mL 0.5 mol·L-1的硫酸溶液中,下图为反应产氢速率与反应时间的关系图。
(1)关于图像的描述不正确的是_③_____(2分)
①a→c段产生氢气的速率增加较快可能是表面的氧化膜逐渐溶解,加快了反应的速率
②a→c段产生氢气的速率增加较快可能是该反应放热,导致温度升高,加快了反应
③c以后,产生氢气的速率逐渐下降可能是铝片趋于消耗完全
(2)书写O→a段所对应的离子方程式____________________________________(2分)
(3)若其他条件不变,现换用500mL1mol·L-1盐酸,产生氢气速率普遍较使用500mL 0.5mol·L-1硫酸的快,可能的原因是_②④_______(2分)
①盐酸中c(H+)的浓度更大 ②Cl—有催化作用 ③SO42—有催化作用
④SO42—有阻化作用 ⑤Al3+有催化作用
(4)根据所学,若要加快铝片与硫酸溶液制H2的反应速率,小组成员提出一系列方案,比如:①加入某种催化剂;②滴加少量CuSO4溶液;③将铝片剪成100条;④增加硫酸的浓度至18mol/L;⑤加入蒸馏水;⑥加入少量KNO3溶液;⑦_____________。(2分)
其中,你认为不合理的方案有_____________(2分),并请你再补充一种合理方案,填入空白⑦处。
 2H2↑+O2↑
2H2↑+O2↑ 2H2↑+O2↑
2H2↑+O2↑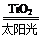 2H2↑+O2↑
2H2↑+O2↑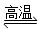 CO+ 3H2
CO+ 3H2 CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。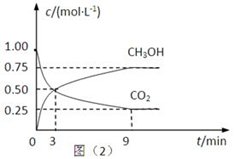
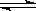 CH3OH(g) ΔH1
CH3OH(g) ΔH1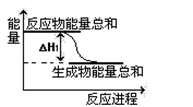
 粤公网安备 44130202000953号
粤公网安备 44130202000953号