以五倍子为原料可制得A,A的结构简式如下图所示,试回答下列问题: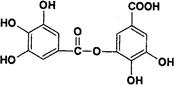
(1)A的分子式为_______________。
(2)有机化合物B在硫酸催化条件下加热发生酯化可得到A。则B的结构简式为______________。
(3)写出A与过量NaOH溶液反应的化学方程式__________________________________。
以五倍子为原料可制得A,A的结构简式如下图所示,试回答下列问题:
(1)A的分子式为_______________。
(2)有机化合物B在硫酸催化条件下加热发生酯化可得到A。则B的结构简式为______________。
(3)写出A与过量NaOH溶液反应的化学方程式__________________________________。