近年来,我国部分地区相继发现一些以发热伴血小板减少为主要表现的感染性疾病病例。氯吡格雷是一种用于抑制血小板聚集的药物,根据原料的不同,该药物的合成路线通常有两条,其中一种合成路线如下:
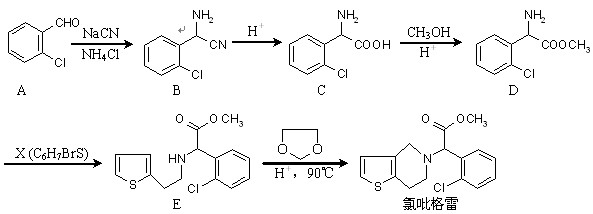
|
请回答下列问题:
(1)D的官能团除了氯原子外还有(填名称) 。(2)有关A、C、D的下列说法正确的是
A.C→D的反应属于取代反应
B.A能与H2发生还原反应,但不能发生氧化反应
C.A、C、D在一定条件下都能与NaOH溶液反应
D.D易溶于水和氯仿
(3)X的结构简式为 。
(4) E与
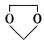 在酸性条件下生成氯吡格雷和另一种常见有机物,试写出该反应的化学方程式。
在酸性条件下生成氯吡格雷和另一种常见有机物,试写出该反应的化学方程式。(5)写出A属于芳香族化合物的所有同分异构体的结构简式: 。
(6)已知:
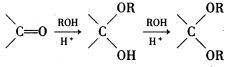
在下列方框内写出由乙烯、甲醇为有机原料制备化合物
 的合成路线流程图(无机试剂任选)。合成路线流程示意图为:
的合成路线流程图(无机试剂任选)。合成路线流程示意图为: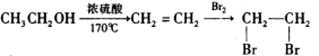
 粤公网安备 44130202000953号
粤公网安备 44130202000953号