(10分,每空1分)a、b、c、d、e是含有一种相同元素的五种物质,可发生如下转化: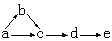
其中: a是单质;b是气体;c、d是氧化物;e是最高价氧化物对应的水化物。
(1)如果a是一种淡黄色粉末固体,试推断这五种物质(用化学式表示):
a ;b ;c ;d ;e 。
(2)如果a是一种常见气体,试推断这五种物质(用化学式表示):
a ;b ;c ;d ;e 。
(10分,每空1分)a、b、c、d、e是含有一种相同元素的五种物质,可发生如下转化: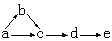
其中: a是单质;b是气体;c、d是氧化物;e是最高价氧化物对应的水化物。
(1)如果a是一种淡黄色粉末固体,试推断这五种物质(用化学式表示):
a ;b ;c ;d ;e 。
(2)如果a是一种常见气体,试推断这五种物质(用化学式表示):
a ;b ;c ;d ;e 。