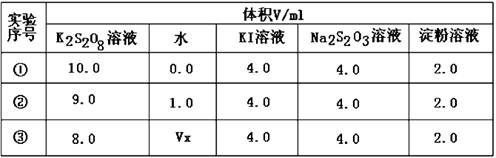
某研究小组模拟工业上以黄铁矿为原料制备硫酸的第一步反应:
4FeS2+11O2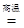 2Fe2O3+8SO2,进行以下实验,并测定该样品中FeS2样品的纯度(假设其它杂质不参与反应)。
2Fe2O3+8SO2,进行以下实验,并测定该样品中FeS2样品的纯度(假设其它杂质不参与反应)。
实验步骤:称取研细的样品4.000g放入上图b装置中,然后在空气中进行煅烧。为测定未反应高锰酸钾的量(假设其溶液体积保持不变),实验完成后取出d中溶液10mL置于锥形瓶里,用0.1000mol/L草酸(H2C2O4)标准溶液进行滴定。
(已知:5SO2 + 2KMnO4 + 2H2O ="=" K2SO4 + 2MnSO4 + 2H2SO4 )
请回答下列问题:
(1)称量样品质量能否用托盘天平 (填“能”或“不能”);
(2)装置a的作用是 ;
(3)上述反应结束后,仍需通一段时间的空气,其目的是 ;
(4)滴定时,发生反应的离子方程式为 ,已知滴定管初读数为0.10mL,末读数如上图所示,消耗草酸溶液的体积为 mL;
(5)该样品中FeS2的纯度为 ;
(6)若用下图装置替代上述实验装置d,同样可以达到实验目的的是 。(填编号)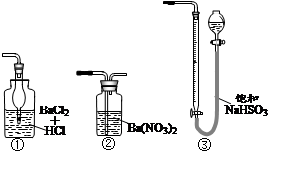
 Cu(NO2)42-(绿色)
Cu(NO2)42-(绿色)




 粤公网安备 44130202000953号
粤公网安备 44130202000953号