X是一种可用作果实催熟剂的气体。现有如下的反应关系: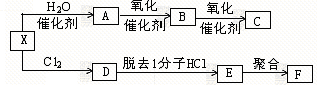
已知F是合成高分子化合物,用于制备塑料和合成纤维。
(1)用结构简式表示:A 、C 、F ;
(2) A→B的化学方程式为 ,反应类型为 。
X是一种可用作果实催熟剂的气体。现有如下的反应关系:
已知F是合成高分子化合物,用于制备塑料和合成纤维。
(1)用结构简式表示:A 、C 、F ;
(2) A→B的化学方程式为 ,反应类型为 。