有一透明溶液,可能含有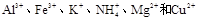 等离子中的一种或几种。现加入Na2O2粉末只有无色无味的气体放出,并同时析出白色沉淀。如加入Na2O2的量与生成白色沉淀的量之间的关系用下图来表示。
等离子中的一种或几种。现加入Na2O2粉末只有无色无味的气体放出,并同时析出白色沉淀。如加入Na2O2的量与生成白色沉淀的量之间的关系用下图来表示。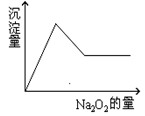
试推断:原溶液中一定含有 ;一定没有 ,可能含 ,为了进一步确定可能含有的离子,应增加的实验操作为 ,现象为 。
有一透明溶液,可能含有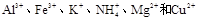 等离子中的一种或几种。现加入Na2O2粉末只有无色无味的气体放出,并同时析出白色沉淀。如加入Na2O2的量与生成白色沉淀的量之间的关系用下图来表示。
等离子中的一种或几种。现加入Na2O2粉末只有无色无味的气体放出,并同时析出白色沉淀。如加入Na2O2的量与生成白色沉淀的量之间的关系用下图来表示。
试推断:原溶液中一定含有 ;一定没有 ,可能含 ,为了进一步确定可能含有的离子,应增加的实验操作为 ,现象为 。