(每空2分,共12分) 根据下面的反应路线及所给信息填空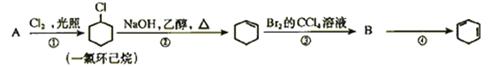
(1)A的结构简式是 B的结构简式是
(2)①的反应类型是 。③的反应类型是 。
④的反应类型是
(3)反应④的化学方程式是 。
(每空2分,共12分) 根据下面的反应路线及所给信息填空
(1)A的结构简式是 B的结构简式是
(2)①的反应类型是 。③的反应类型是 。
④的反应类型是
(3)反应④的化学方程式是 。