(8分)已知乳酸的结构简式为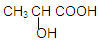 ,试类比乙醇中—OH和乙酸中—COOH的性质,回答下列问题:
,试类比乙醇中—OH和乙酸中—COOH的性质,回答下列问题:
(1)写出乳酸发生下列反应的化学方程式
①与足量的金属钠反应________________________________________
②与少量的碳酸钠反应 _______________________________________
(2)由乳酸的组成和结构推断还可能发生的哪些类型的反应,写出两种反应类型: 。
(8分)已知乳酸的结构简式为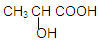 ,试类比乙醇中—OH和乙酸中—COOH的性质,回答下列问题:
,试类比乙醇中—OH和乙酸中—COOH的性质,回答下列问题:
(1)写出乳酸发生下列反应的化学方程式
①与足量的金属钠反应________________________________________
②与少量的碳酸钠反应 _______________________________________
(2)由乳酸的组成和结构推断还可能发生的哪些类型的反应,写出两种反应类型: 。