按如图所示,两个烧杯中分别盛有足量的稀硫酸溶液和氯化铜溶液: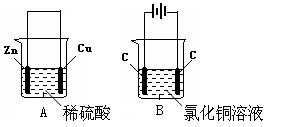
(1)A,B两个装置中,属于原电池的是 (填标号)
(2)A池中,铜极为 极,发生 反应,(填“氧化”“还原”)电极反应式为: 。
(3)B池中,左边C是 极,电极反应式为: ;
总反应式为 。
(4)B池中当阴极产生6.4g铜时,阳极放出 g气体。
按如图所示,两个烧杯中分别盛有足量的稀硫酸溶液和氯化铜溶液:
(1)A,B两个装置中,属于原电池的是 (填标号)
(2)A池中,铜极为 极,发生 反应,(填“氧化”“还原”)电极反应式为: 。
(3)B池中,左边C是 极,电极反应式为: ;
总反应式为 。
(4)B池中当阴极产生6.4g铜时,阳极放出 g气体。