(每空3分,共12分) A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应。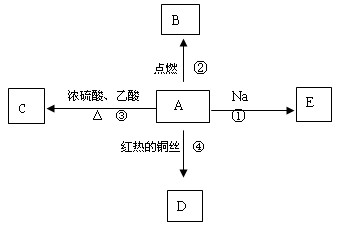
(1)写出A的结构式
(2)写出下列反应的化学方程式(有机物用结构简式表示):
反应①:
反应②:
反应④:
(每空3分,共12分) A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应。
(1)写出A的结构式
(2)写出下列反应的化学方程式(有机物用结构简式表示):
反应①:
反应②:
反应④: