A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应。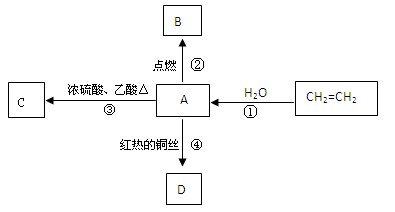
(1)写出A和C的名称或结构简式:
A ,C ;
(2)写出CH2=CH2→A的化学方程式,指出反应类型:
, 。
A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应。
(1)写出A和C的名称或结构简式:
A ,C ;
(2)写出CH2=CH2→A的化学方程式,指出反应类型:
, 。