今有三种化合物结构如下: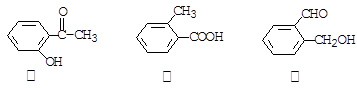
(1) 请写出丙中含氧官能团的名称: 。
(2) 请判断上述哪些化合物互为同分异构体: ___。
(3)写出化合物乙与小苏打溶液反应的化学方程式:
今有三种化合物结构如下: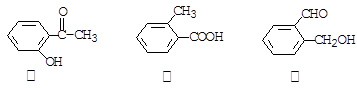
(1) 请写出丙中含氧官能团的名称: 。
(2) 请判断上述哪些化合物互为同分异构体: ___。
(3)写出化合物乙与小苏打溶液反应的化学方程式: