(1)按官能团的不同可以对有机物进行分类,请指出下列有机物的种类,填在横线上。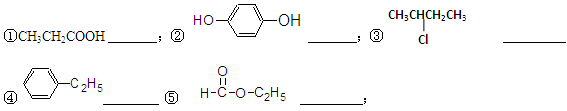
(2)化合物A和B的分子式都是C2H4Br2, A的核磁共振氢谱图如图所示,则A的结构简式为: ,请预测B的核磁共振氢谱上有 个峰(信号)。
(1)按官能团的不同可以对有机物进行分类,请指出下列有机物的种类,填在横线上。
(2)化合物A和B的分子式都是C2H4Br2, A的核磁共振氢谱图如图所示,则A的结构简式为: ,请预测B的核磁共振氢谱上有 个峰(信号)。