(1)0.1mol/L Na2CO3溶液呈 (填“酸性”、“碱性”或“中性”),其原因是 (用离子方程式表示)
(2)氢氧燃料电池是利用氢能的一种重要方式。请写出氢氧燃料电池(电解质溶液为KOH溶液)的负极的电极反应式 ;
(3)某温度下的水溶液中,c(H+)=10-xmol/L,c(OH-)=10-y mol/L。x与y的关系如图所示,该温度下水的离子积为 ;该温度下0.01 mol/L NaOH溶液的pH为 。
(4)如图装置,已知两电极上发生的电极反应分别为:
a极:Cu2++2e-= Cu b极:Fe-2e-= Fe2+
该装置中原电解质溶液一定含有 ;(填序号)
| A.Cu2+ | B.Na+ | C.Fe2+ | D.Ag+ |

(5)硫酸钡在水中存在沉淀溶解平衡:BaSO4(s) Ba2+ (aq)+ SO42-(aq) 25℃时,BaSO4的Ksp=1.1×l0—10,在0.1 mol·L一1硫酸溶液中,钡离子的浓度最大可达到 mol·L一1。
Ba2+ (aq)+ SO42-(aq) 25℃时,BaSO4的Ksp=1.1×l0—10,在0.1 mol·L一1硫酸溶液中,钡离子的浓度最大可达到 mol·L一1。
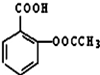 ,难溶于水.为了使疗效更好,
,难溶于水.为了使疗效更好,
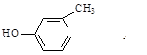

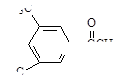 E.
E. F.
F.
 粤公网安备 44130202000953号
粤公网安备 44130202000953号