(1)元素的第一电离能:(填">"或"<")。
(2)基态的核外电子排布式为。
(3)硅烷()的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是。

(4)硼砂是含结晶水的四硼酸钠,其阴离子(含三种元素)的球棍模型如图所示
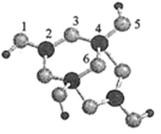
①在中,硼原子轨道的杂化类型有;配位键存在于原子之间(填原子的数字标号);=(填数字)。
②硼砂晶体由、和构成,它们之间的作用力有(填序号)。
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键
(1)元素的第一电离能:(填">"或"<")。
(2)基态的核外电子排布式为。
(3)硅烷()的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是。

(4)硼砂是含结晶水的四硼酸钠,其阴离子(含三种元素)的球棍模型如图所示

①在中,硼原子轨道的杂化类型有;配位键存在于原子之间(填原子的数字标号);=(填数字)。
②硼砂晶体由、和构成,它们之间的作用力有(填序号)。
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键