新合成的一种烃,其碳架呈三棱柱体(如图所示)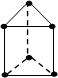
(1)写出该烃的分子式
(2)该烃的一氯取代物是否有同分异构体
(3)该烃的二氯取代物有多少种
(4)该烃的同分异构体有很多种,其中1种不能使酸性高锰酸钾溶液或Br2-CCl4溶液褪色,但在一定条件下能跟溴(或H2)发生取代(或加成)反应,这种同分异构体的结构简式是
新合成的一种烃,其碳架呈三棱柱体(如图所示)
(1)写出该烃的分子式
(2)该烃的一氯取代物是否有同分异构体
(3)该烃的二氯取代物有多少种
(4)该烃的同分异构体有很多种,其中1种不能使酸性高锰酸钾溶液或Br2-CCl4溶液褪色,但在一定条件下能跟溴(或H2)发生取代(或加成)反应,这种同分异构体的结构简式是