①②③④⑤五种元素,在元素周期表中的位置如图所示。回答下列问题: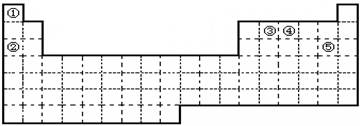
(1)上述五种元素中,金属性最强的元素在周期表中的位置是 ,
该元素的单质在空气中加热的化学方程式为 。
(2)元素①和④形成化合物的电子式是 ,其水溶液呈 (填“碱性”、“酸性”或“中性”)。
(3)试用电子式表示元素⑤单质分子的形成过程 。
①②③④⑤五种元素,在元素周期表中的位置如图所示。回答下列问题:
(1)上述五种元素中,金属性最强的元素在周期表中的位置是 ,
该元素的单质在空气中加热的化学方程式为 。
(2)元素①和④形成化合物的电子式是 ,其水溶液呈 (填“碱性”、“酸性”或“中性”)。
(3)试用电子式表示元素⑤单质分子的形成过程 。