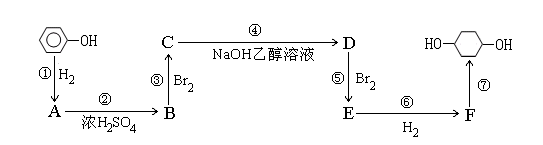
以苯酚为原料的合成路线如下所示,请按要求作答:
(1)写出以下物质的结构简式:B F
(2)写出反应①④的化学反应方程式:
①
④
(3)反应⑤可以得到E,同时可能得到的副产物的结构简式为:

以苯酚为原料的合成路线如下所示,请按要求作答:
(1)写出以下物质的结构简式:B F
(2)写出反应①④的化学反应方程式:
①
④
(3)反应⑤可以得到E,同时可能得到的副产物的结构简式为: