(1)在 H、
H、 H、
H、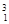 H、
H、 Mg、
Mg、 Mg和
Mg和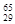 Cu中共有___ ___种元素,__ ____种原子。
Cu中共有___ ___种元素,__ ____种原子。
(2) 射线是由粒子组成的,粒子是一种没有核外电子的粒子,它带有2个单位正电荷,它的质量数等于4,由此推断粒子带有_________个中子。
(1)在 H、
H、 H、
H、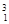 H、
H、 Mg、
Mg、 Mg和
Mg和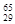 Cu中共有___ ___种元素,__ ____种原子。
Cu中共有___ ___种元素,__ ____种原子。
(2) 射线是由粒子组成的,粒子是一种没有核外电子的粒子,它带有2个单位正电荷,它的质量数等于4,由此推断粒子带有_________个中子。