有机化合物A~H的转换关系如下所示: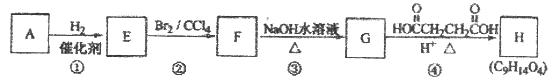
请回答下列问题:
(1)链烃A有支链且只有一个官能团,其相对分子质量为68,则A的分子式为 ,结构简式是 :
(2)在特定催化剂作用下,A与等物质的量的H2反应生成E。由E转化为F的化学方程式是 ;
(3)①的反应类型是 ;③的反应类型是
(4)G与金属钠反应能放出气体,由G转化为H的化学方程式是
有机化合物A~H的转换关系如下所示:
请回答下列问题:
(1)链烃A有支链且只有一个官能团,其相对分子质量为68,则A的分子式为 ,结构简式是 :
(2)在特定催化剂作用下,A与等物质的量的H2反应生成E。由E转化为F的化学方程式是 ;
(3)①的反应类型是 ;③的反应类型是
(4)G与金属钠反应能放出气体,由G转化为H的化学方程式是