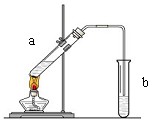
某实验小组用下列装置进行乙醇催化氧化的实验。已知:乙醛可被氧化为乙酸。
⑴实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式______________________、______________________。
⑵在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应
是 反应。
⑶若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有 。要除去该物质,可在混合液中加入 (填写字母)。
| A.氯化钠溶液 | B.苯 | C.碳酸氢钠溶液 | D.四氯化碳 |
然后,再通过 (填实验操作名称)即可除去。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号