1909年化学家哈伯在实验室首次合成了氨。2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体表面合成氨的反应过程,示意如下图:
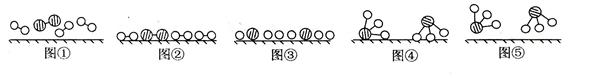
(1)图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是______,______。
(2)已知:4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(g);ΔH= - 1266.8 kJ/mol
N2(g) + O2(g) =" 2NO(g)" ;ΔH =" +" 180.5kJ/mol, 氨催化氧化的热化学方程式为__________。
(3)500℃下,在A、B两个容器中均发生合成氨的反应。隔板Ⅰ固定不动,活塞Ⅱ可自由移动。

①当合成氨在容器B中达平衡时,测得其中含有1.0molN2,0.4molH2,0.4molNH3,此时容积为2.0L。则此条件下的平衡常数为____________;保持温度和压强不变,向此容器中通入0.36molN2,平衡将__________(填“正向”、“逆向”或“不”)移动。
②向A、B两容器中均通入xmolN2和ymolH2,初始A、B容积相同,并保持温度不变。若要平衡时保持N2在A、B两容器中的体积分数相同,则x与y之间必须满足的关系式为____。