已知:①丙烯与水进行加成反应,其可能的产物有两种;②下图中E为开链的酯类化合物,其分子式为C6H12O2。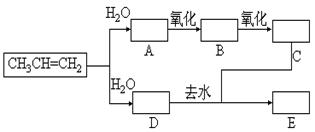
(1)请依据上述件和图中转化关系,写出化合物的结构简式。
A E
(2)D和浓HBr微热生成有机物F,写出有关反应的化学方程式
D+C→E的方程式:
B与新制银氨溶液反应的方程式:
已知:①丙烯与水进行加成反应,其可能的产物有两种;②下图中E为开链的酯类化合物,其分子式为C6H12O2。
(1)请依据上述件和图中转化关系,写出化合物的结构简式。
A E
(2)D和浓HBr微热生成有机物F,写出有关反应的化学方程式
D+C→E的方程式:
B与新制银氨溶液反应的方程式: